研究室のVision Vision of the Laboratory

本HPのトップ画面の3つの写真が表すように、以下の3つを大きな目標としています:
As represented by the three images on the homepage, our laboratory has three major goals:
- 腎臓から全身に放出されるメッセージ物質(細胞外小胞)や疾患シグナルの実体(臓器間相互作用)を解き明かす
Deciphering the message molecules (extracellular vesicles) and disease signals released from the kidney to the entire body, and understanding inter-organ interactions. - 腎臓内部で繰り広げられる細胞間相互作用を生化学的に理解する
Biochemically understanding the cellular interactions occurring within the kidney. - 基礎研究と臨床研究を統合し、新規治療薬シーズの実装や既存薬のドラッグリポジショニングを行う
Integrating basic and clinical research to implement novel therapeutic seeds and optimize existing drugs through drug repositioning.
基礎研究と臨床研究を両輪として駆動できる研究環境、基礎研究—臨床研究—臨床を繋ぐチーム力で、生命の寿命=健康寿命となる先駆的診断・治療技術を創る、それがわたしたちのvisionです。
Our vision is to create pioneering diagnostic and therapeutic technologies that align lifespan with healthspan, driven by a research environment that integrates basic and clinical research and a team capable of bridging the gap between research and clinical practice.
研究内容 Research Themes
腎臓と全身の臓器間相互作用と生体の恒常性維持機構の解明:透析に代わる薬を創る
Understanding the Mechanisms of Kidney-Body Interactions and Homeostasis: Developing Alternatives to Dialysis
わたしたちは、CRISPR/Cas9によるゲノム編集技術を一塩基多型(SNP)の機能解析に応用しました。20%のヒトが保有する高血圧感受性SNP STK39 rs3754777 の生物学的機能を解明し、本態性高血圧症の病態解明に貢献しました(Hypertension 2015)。この多型は肥満や糖尿病の疾患感受性にも関わることから、腎臓-代謝臓器間相互作用を解析対象とするために、培養細胞や動物モデルを用いて骨格筋肥大・再生モデルを構築しました。研究の結果、STK39のコードタンパク質SPAKがリン酸化を制御するNa-K-Cl共輸送体が骨格筋形成を制御しており、ループ利尿薬がサルコペニアに寄与すること(Sci Rep 2017)や、SPAKを基質とする血圧制御因子WNK1キナーゼが筋肥大を引き起こすこと(Sci Rep 2018)を発見しました。
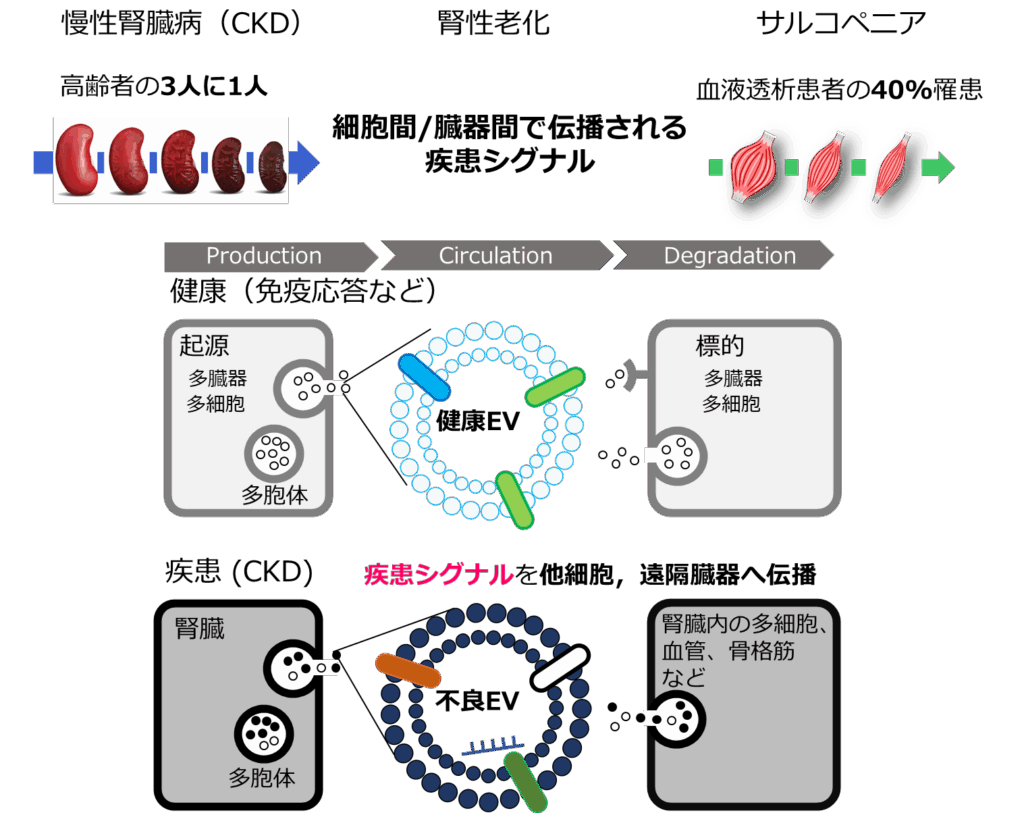
これらの研究背景を基に、現在の研究室では、細胞外小胞を介した細胞間・臓器間相互作用に着目し、腎臓病と遠隔臓器障害(動脈硬化やサルコペニア)の新たな病態解明と創薬研究を進めています。
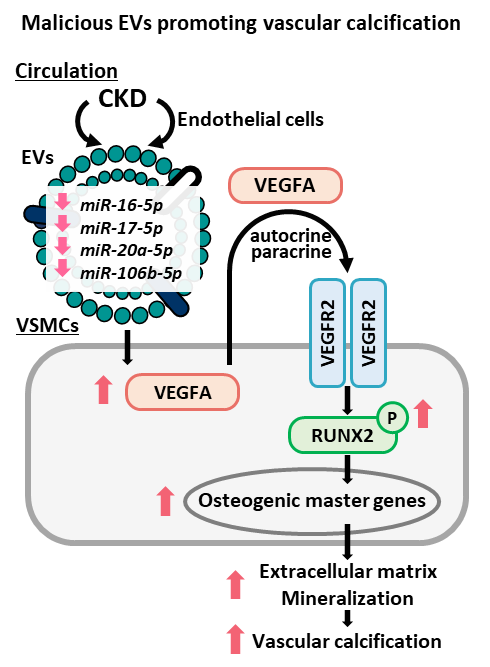
その一つの成果として、血液中の循環細胞外小胞(circulating extracellular vesicles, cEV)が内包する鍵分子群が、血管平滑筋細胞の骨芽細胞様の形質転換・石灰化を引き起こすことを治療薬シーズとともに報告しました(Circulation Research 2023)(プレスリリース「慢性腎臓病において血管石灰化を引き起こす悪玉メッセージ物質を発見」)。腎不全環境下で引き起こる現象を解析することで、生体の新たな恒常性維持機構の理解、サルコペニアなど老化の制御に繋がる研究開発、創薬研究を進めています。
We have applied CRISPR/Cas9 genome editing technology to analyze the function of single nucleotide polymorphisms (SNPs). Our research elucidated the biological function of the hypertension-susceptibility SNP STK39 rs3754777, which is carried by 20% of the human population, contributing to the understanding of essential hypertension (Hypertension 2015). This SNP is also associated with susceptibility to obesity and diabetes. To investigate kidney-metabolic organ interactions, we developed skeletal muscle hypertrophy and regeneration models using cultured cells and animal models. Our findings revealed that the STK39-encoded protein SPAK regulates the phosphorylation of Na-K-Cl cotransporters, which control muscle formation, and that loop diuretics contribute to sarcopenia (Sci Rep 2017). Additionally, we discovered that WNK1 kinase, a blood pressure regulator and SPAK substrate, induces muscle hypertrophy (Sci Rep 2018).
Building on this foundation, our laboratory is now focusing on the role of extracellular vesicles (EVs) in mediating intercellular and inter-organ interactions. We aim to uncover novel mechanisms underlying kidney disease and distant organ dysfunctions, such as atherosclerosis and sarcopenia, and to develop innovative therapeutic strategies.
One of our key findings demonstrated that circulating extracellular vesicles (cEVs) in the blood, containing specific key molecules, induce osteoblast-like phenotypic transformation and calcification of vascular smooth muscle cells. This was reported alongside potential therapeutic seeds (Circulation Research 2023). By analyzing phenomena occurring in the context of kidney failure, we aim to advance our understanding of novel homeostatic mechanisms, control aging-related conditions like sarcopenia, and drive drug discovery efforts.
不良化細胞外小胞を標的とした慢性腎臓病の生化学的病態解明: 新しいクラスの腎臓病治療薬を創る
Targeting Malicious Extracellular Vesicles to Uncover the Biochemical Pathology of Chronic Kidney Disease: Developing a New Class of Kidney Disease Therapies
慢性腎臓病(CKD)の病態そのものを治療可能な「最終共通経路」は未解明のままであり、CKD診療は半世紀以上にわたり透析に依存してきました。ヒト腎組織のmyofibroblast線維化は、尿細管間質のfibroblastを起源とすることが判明しています(Kuppe C. Nature 2021)。さらに、尿細管上皮細胞の傷害を起点とした微小環境の変化が線維化に至る重要な経路であることが示されました(Lake BB. Nature 2023)。しかし、線維化そのものは上皮の生理学的な修復過程であり、治療標的とはなりませんでした。
私たちはこれまで、腎不全環境下における臓器間相互作用に着目し、‘不良化’した小型細胞外小胞(small extracellular vesicles, EVs)が重要な病的役割を果たすことを明らかにしてきました。EVは全細胞が恒常的に分泌する40-150 nmの微粒子であり、細胞間の情報伝達に関与します。本研究では、疾患モデル動物および患者を対象に、不良EVが腎微小環境内で果たす細胞間相互作用を解明し、治療可能な共通病態経路を特定することを目指します。また、これに基づき、新しいクラスのCKD治療薬の創薬を目指しています。
The “final common pathway” that could potentially treat the pathology of chronic kidney disease (CKD) remains unidentified, and CKD treatment has relied on dialysis for over half a century. Myofibroblast fibrosis in human kidney tissue has been shown to originate from fibroblasts in the tubulointerstitial region (Kuppe C. Nature 2021). Furthermore, changes in the microenvironment triggered by tubular epithelial cell injury have been identified as a critical pathway leading to fibrosis (Lake BB. Nature 2023). However, fibrosis itself is a physiological repair process of the epithelium and has not been a viable therapeutic target.
Our research has focused on inter-organ interactions in the context of kidney failure, revealing that “malicious” small extracellular vesicles (sEVs) play a significant pathological role. EVs are 40-150 nm particles secreted by all cells and are involved in intercellular communication. This study aims to elucidate the role of dysfunctional EVs in cell-cell interactions within the kidney microenvironment using disease model animals and patient samples. Based on these findings, we aim to identify treatable common pathological pathways and develop a new class of CKD therapies.
慢性腎臓病によるmulti-morbidity(多疾患併存)、disease complexity(病態複雑性)を克服するための臨床研究:腎臓病患者のQOL向上と診療最適化を目指す
Clinical Research to Overcome Multi-Morbidity and Disease Complexity in Chronic Kidney Disease (CKD): Improving QOL and Optimizing Treatment for CKD Patients
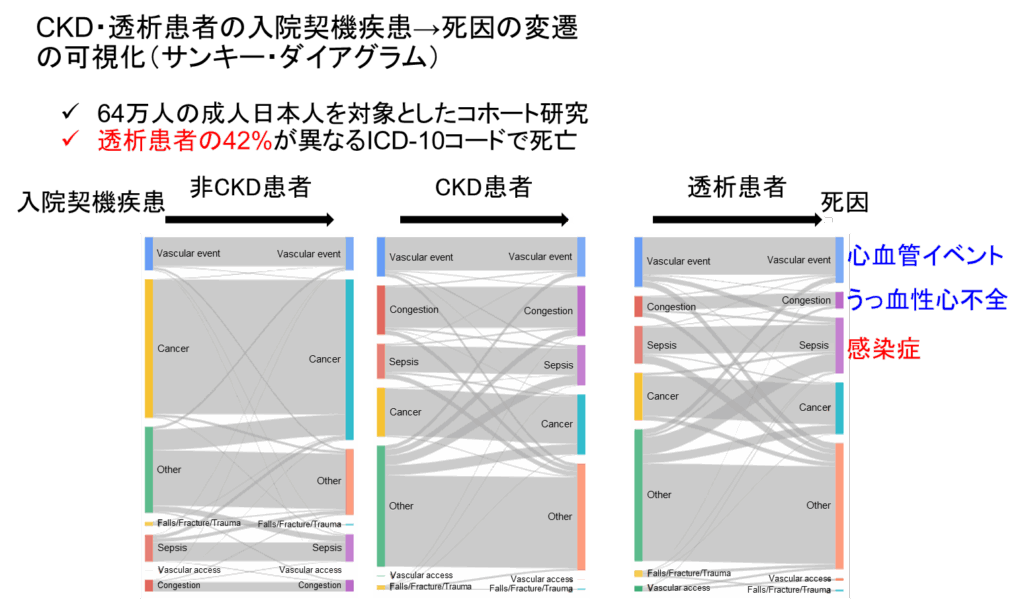
CKDは、透析を必要としない軽症~中等症段階から全身の臓器に悪影響を及ぼすことが分かってきています。私たちの研究グループはこれまで、CKDに潜在する複雑な病態と多併存症、診療成績を向上させる手段について研究してきました。これをよく表す一例として、上の図はCKD患者のmulti-morbidity、入院時~死因となった疾患の変遷を可視化したものです(PLoS One 2021)。
特に、CKDによる病的老化(“腎性老化”)に焦点を当て、腎臓の生体恒常性維持機構の解明を目指した基礎研究と臨床研究を両輪で推進しています。
これまでの研究成果の例として、以下のような知見を得ています:
- 低Na血症と感染症入院リスク増加の関連(BMC Nephrol 2013)
- 低Cl血症の心血管病イベントリスク増加(Clin Exp Nephrol 2017)
- 抗セントロメア抗体陽性・強皮症に特徴的な皮膚症状およびHLAハプロタイプを欠く急性高血圧症候群の発見(Intern Med 2012)
- 大動脈解離後の性差による緊急透析リスク(iScience 2024)
- オステオサルコペニアの実態と筋力低下のCKD進行の強い関連(Bone 2024)
- 急性高血圧の疫学的動向と加齢・フレイルとの関連(Hypertension 2023)
- 透析症例規模が予後に与える影響(Kidney Int Rep 2017)
- 主要大手術の種類に応じた、緊急透析・その開始時期と予後の関連(Int J Surg 2022)
- RAS阻害薬やHIF-PH阻害薬の抗サルコペニア効果(J Ren Nutr 2024, JCSM Commun 2024)
- RAS阻害薬による術後死亡・ADLリスク低下(Eur Heart J Open 2025)
また、EV(細胞外小胞)の内包物を用いた革新的バイオマーカーの開発を行い、その診断方法に基づいたEV制御薬や既存薬の最適化を目指して、基礎研究と臨床研究を統合した研究戦略を推進しています。
CKD has been shown to adversely affect multiple organs in the body, even in its mild to moderate stages that do not require dialysis. Our research group has been dedicated to investigating the complex pathophysiology and multi-morbidity associated with CKD, as well as strategies to improve clinical outcomes. In particular, we focus on pathological aging caused by CKD (“renal aging”) and aim to elucidate the mechanisms of renal homeostasis through a dual approach of basic and clinical research.
Our research has yielded significant findings, including:
- Association between hyponatremia and increased risk of infection-related hospitalization (BMC Nephrol 2013)
- Association between hypochloremia and increased cardiovascular event risk (Clin Exp Nephrol 2017)
- Discovery of acute hypertensive syndrome characterized by anti-centromere antibody positivity, scleroderma-specific skin symptoms, and absence of HLA haplotypes (Intern Med 2012)
- Sex differences in the risk of emergency dialysis after aortic dissection (iScience 2024)
- Strong association between osteosarcopenia and CKD progression due to muscle weakness (Bone 2024)
- Epidemiological trends of acute hypertension and its association with aging and frailty (Hypertension 2023)
- Impact of dialysis case volume on patient prognosis (Kidney Int Rep 2018)
- Correlation between types of major surgeries, timing of emergency dialysis, and prognosis (Int J Surg 2022)
- Anti-sarcopenic effects of RAS inhibitors and HIF-PH inhibitors (J Ren Nutr 2023, JCSM Commun 2024)
- Reduction in postoperative mortality and ADL risk by RAS inhibitors (Eur Heart J Open 2025)
Additionally, we have developed innovative biomarkers using the contents of extracellular vesicles (EVs) and are advancing research strategies that integrate basic and clinical studies to optimize EV-targeted therapies and existing drugs.



